CULTUROMIQUE
Présentation
C’est un partenaire privilégié dans la réalisation de projets scientifiques en lien avec la microbiologie.
Nos offres de service
La complémentarité de ces outils va permettre de :
- Dénombrer, caractériser, isoler les microorganismes d’écosystèmes variés (aquatiques, sols, atmosphères, plantes, animaux, hommes…).
- Cultiver les microorganismes en conditions planctoniques, biofilms, en anaérobiose.
- Quantifier directement un élément de génome (ADN ou ARN) dans un échantillon biologique ou environnemental.
- Étudier les interactions de microorganismes avec des cellules eucaryotes.
Moyens technologiques / installations / équipements
Enceinte anaérobie : Boîte à gants (Jacomex)

L'enceinte anaérobie est équipée de 4 gants (2 personnes), d’un incubateur thermostaté et d’une atmosphère anaérobie contrôlée (N2/CO2/H2 90/5/5). Cette enceinte permet la préparation, la culture et/ou l'isolement de microorganismes anaérobies.
Sylvain DENIS (MEDiS) / Sylvie MIQUEL (LMGE) / Adeline SIVIGNON (M2iSH)
Appareil de mesure de résistance transépithéliale

Le CellZscope2 (nanoAnalytics) permet l’étude de l’influence de substances, toxines, molécules ou microorganismes sur la perméabilité de la couche cellulaire par le suivi de l’impédance (TER + capacitance). Cette approche est en temps réel, directe (sans marqueur), adaptable à différents modèles cellulaires et nécessite peu de matériel (inserts de 6,12 ou 24 puits).
Dispositif CellZscope2
Diluteur ensemenceur automatique (Easy spiral)
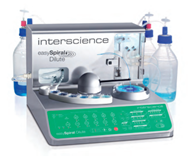 L’easySpiral Dilute® est conçu pour diluer un échantillon jusqu’à une dilution de 10-5, puis ensemencer automatiquement des boites de Petri rondes de 90 ou 150 mm suivant différents modes (exponentiel, constant, cercle, masse) afin de standardiser les ensemencements et faciliter le dénombrement des colonies bactériennes. Il permet un ensemencement de plusieurs dilutions par boite et donc une économie de consommables non négligeable.
L’easySpiral Dilute® est conçu pour diluer un échantillon jusqu’à une dilution de 10-5, puis ensemencer automatiquement des boites de Petri rondes de 90 ou 150 mm suivant différents modes (exponentiel, constant, cercle, masse) afin de standardiser les ensemencements et faciliter le dénombrement des colonies bactériennes. Il permet un ensemencement de plusieurs dilutions par boite et donc une économie de consommables non négligeable.Caroline CHEVARIN (M2iSH), Michaël RODRIGUES (M2iSH), Nicolas CHARBONNEL (LMGE)
Compteur automatique de colonies (Scan 4000)

Ce compteur automatique permet le dénombrement des colonies bactériennes sur boite de Pétri rondes 55, 90, 100, 150 mm et boites carrées 120 mm avec un ensemencement manuel ou automatique grâce à l’easySpiral Dilute®. Il peut dénombrer les colonies sur géloses chromogènes, membranes de filtration et lire des antibiogrammes.
Automate de pipetage et repiquage de colonies (Fluent control T480 TECAN)

Cet automate possède 1 bras avec 8 canaux indépendants permettant le pipetage de volume de 1 à 1000 µL et 1 bras de déplacement pour les microplaques format SBS et boites de Pétri 90 mm. Son utilisation permet la répartition de liquides, dilutions sériées en microplaques etc…L’automate est couplé au module Pickolo® qui permet de repiquer des colonies à partir d’une boite de Petri ronde de 90 mm et de les ensemencer dans une microplaque 96 puits. La sélection des colonies peut se faire par leur taille, leur couleur et leur forme ou leur fluorescente (GFP). Son utilisation requiert la création et la validation du script informatique correspondant aux applications souhaitées. Les consommables utilisés doivent être standardisés et de même référence.
Frédéric FAURE (M2iSH), Laurent NAKUSI (LMGE)Dispositif microfluidique (BioFlux® 200, Fluxion) couplé à un système d'observation (Axio-Observer 7, Zeiss)
 Le système BioFlux permet de réaliser des essais basés sur les cellules dans des conditions physiologiques d'écoulement. Grâce à l’utilisation de microplaques avec un composant microfluidique intégré, un flux variable et contrôlé (0,1-200 dyne/cm2) est obtenu dans le canal de la microplaque. Ce système permet l’étude de la formation de biofilm, de cellules adhérentes sous un flux. Un microscope inversée à épifluorescence (enceinte thermostatée, contrôleur CO2, Apotome, platine motorisée,…) permet une imagerie automatisée pour l’analyse de cellules vivantes sous flux de cisaillement.
Le système BioFlux permet de réaliser des essais basés sur les cellules dans des conditions physiologiques d'écoulement. Grâce à l’utilisation de microplaques avec un composant microfluidique intégré, un flux variable et contrôlé (0,1-200 dyne/cm2) est obtenu dans le canal de la microplaque. Ce système permet l’étude de la formation de biofilm, de cellules adhérentes sous un flux. Un microscope inversée à épifluorescence (enceinte thermostatée, contrôleur CO2, Apotome, platine motorisée,…) permet une imagerie automatisée pour l’analyse de cellules vivantes sous flux de cisaillement.
Dispositif microfluidique
Lecteur de multiplaques (Spark Cyto 400, Tecan)
 C’est un lecteur de plaques multimode doté de capacités d’imagerie par fluorescence et de cytométrie qui permet de nouvelles possibilités pour les recherches sur les cellules. En associant l'imagerie des cellules vivantes à des technologies de détection de pointe, les informations qualitatives et quantitatives sont regroupées dans des ensembles de données multi-paramètres uniques. Il y a trois modes de lectures : Absorbance : monochromateur, UV/Visible de 200 nm à 1000 nm, en point final ou cinétique, Fluorescence : Double monochromateur, Excitation 230-900nm Emission 280-900 nm, lecture par le dessus et/ou dessous, fluo en temps résolu TR, Luminescence : 38 filtres, scans de luminescence de 390 nm à 660 nm, mesures multiplex. Pour l’imagerie : un champ clair, 4 couleurs fluorescentes (bleu, vert, rouge et proche IR), 3 objectifs (x2, x4 et x10), contraste de phase numérique et autofocus à base de LED sont disponibles.
C’est un lecteur de plaques multimode doté de capacités d’imagerie par fluorescence et de cytométrie qui permet de nouvelles possibilités pour les recherches sur les cellules. En associant l'imagerie des cellules vivantes à des technologies de détection de pointe, les informations qualitatives et quantitatives sont regroupées dans des ensembles de données multi-paramètres uniques. Il y a trois modes de lectures : Absorbance : monochromateur, UV/Visible de 200 nm à 1000 nm, en point final ou cinétique, Fluorescence : Double monochromateur, Excitation 230-900nm Emission 280-900 nm, lecture par le dessus et/ou dessous, fluo en temps résolu TR, Luminescence : 38 filtres, scans de luminescence de 390 nm à 660 nm, mesures multiplex. Pour l’imagerie : un champ clair, 4 couleurs fluorescentes (bleu, vert, rouge et proche IR), 3 objectifs (x2, x4 et x10), contraste de phase numérique et autofocus à base de LED sont disponibles.Caroline CHEVARIN (M2iSH), Damien BALESTRINO (LMGE)
PCR digitale (dPCR) (Biorad)
 La PCR digitale permet de quantifier directement un élément de génome (ADN ou ARN) dans un échantillon biologique ou environnemental. Elle permet une quantification absolue des acides nucléiques de façon indépendante de l’efficacité de PCR. Son principe est de répartir l’ADN dans plusieurs milliers gouttelettes (10°000 à 20°000) réalisant autant de PCR indépendantes. La détection de la réaction de PCR se fait en point final, basé sur la détection d’une fluorescence. La quantification de la cible de l’échantillon ne nécessite pas de courbe d’étalonnage.
La PCR digitale permet de quantifier directement un élément de génome (ADN ou ARN) dans un échantillon biologique ou environnemental. Elle permet une quantification absolue des acides nucléiques de façon indépendante de l’efficacité de PCR. Son principe est de répartir l’ADN dans plusieurs milliers gouttelettes (10°000 à 20°000) réalisant autant de PCR indépendantes. La détection de la réaction de PCR se fait en point final, basé sur la détection d’une fluorescence. La quantification de la cible de l’échantillon ne nécessite pas de courbe d’étalonnage.
Présentation de l'appareil ddPCR
MALDI-TOF MS : MALDI Biotyper® sirius (Bruker)

Le MALDI Biotyper® sirius est un MALDI-TOF MS - pour désorption-ionisation laser assistée par matrice couplée à un spectromètre de masse à temps de vol - développé pour l’identification de microorganismes. Cette technologie permet, directement à partir de colonies, de produire des spectres de masse. Les profils obtenus sont comparés à une banque de données permettant d’identifier les souches testées.
Deux modes d’ionisation des échantillons sont disponibles :
- Ionisation positive : Pour une analyse protéomique de l’échantillon, permettant d’identifier jusqu’à l’espèce ou groupe d’espèces.
- Ionisation négative : Pour une analyse lipidomique de l’échantillon, permettant par exemple la détection de résistances antimicrobiennes comme celle de la colistine, associée à une modification du lipide A.
Cet appareil permet d’analyser jusqu'à 600 échantillons par heure. La banque de données de Bruker contient les spectres de plus de 4000 espèces ou groupe d’espèces de bactéries à Gram positif, Gram négatif et de levures.
Il est aussi équipé de deux modules :
- Le module MBT HT Subtyping, permettant la détection automatique de marqueurs spécifiques de certaines souches facilitant leur différenciation ou la détection de marqueurs de résistance.
- Le module Explorer, permettant de créer sa propre base de données et de partager des spectres avec d’autres laboratoires équipés.
Mini bioréacteurs : DASbox® (Eppendorf)

Le système DASbox® est composé de 4 mini bioréacteurs entièrement instrumentés et indépendants. Il est conçu pour de la fermentation microbienne ou pour de la culture cellulaire.
Chaque unité a un volume de travail compris entre 60 et 250 mL et permet de contrôler précisément un ensemble de paramètres critiques : pH, potentiel redox, température, composition du mélange de gaz injecté (air, N2, O2 et CO2), etc.
Chaque unité est équipée de sondes pH, redox et température, de deux pompes péristaltiques, d’un système d’agitation, d’un condenseur Peltier, d’une unité de régulation thermique sans circulation d’eau et d’un module de mélange gazeux.
Cette flexibilité et les petits volumes en font en une solution idéale pour le développement de procédés, le screening ou l’optimisation de cultures.





